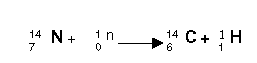GRUPO DE FISICA NUCLEAR
FACULTAD DE FISICAS (UCM)
Dpto. Física Atómica, Molecular y Nuclear
RADIACTIVIDAD
INTRODUCCION
El término radiactividad se encuentra bastante extendido en la sociedad. Se habla de residuos radiactivos, datación de restos arqueológicos usando isótopos radiactivos (Como el Carbono 14), bombas nucleares, aplicaciones médicas... El debate sobre los beneficios e inconvenientes de la energía nuclear como fuente de energía frente a las otras alternativas (petróleo, carbón y gas natural por un lado y la energía solar, eólica, hidroeléctrica.. por el otro) también es y seguirá siendo un asunto candente en los próximos años.
Sin embargo, realmente es poco lo que se conoce del tema. Hace falta conocer los beneficios que genera, los alcances científicos
y las precauciones que se debe tener con el manejo de la radiactividad, además es interesante informarse sobre el por qué ocurren, más sabiendo que todos los seres vivos están involucrados, se quiera o no con ella, no importando el lugar en donde se encuentren, ya sea en la casa, en la oficina, en el campo, en la calle, o en el colegio.
¿Qué es la radiactividad? ¿Cuál es su origen? ¿Cuales son sus aplicaciones y sus riesgos? ¿Se puede observar?
En esta página intentaremos responder de una manera clara y no excesivamente técnica a estas cuestiones. Confiamos en hacer accesible estos temas a un público general, sin que se requieran conocimientos científicos complejos. Es muy importante que los investigadores expliquen y muestren estos temas (de gran importancia en los tiempos modernos) a la gente, evitando el oscurantismo que rodea en muchos casos a esta disciplina.
La iniciativa de la Comunidad de Madrid: "Madrid por la Ciencia" es un foro ideal para que la sociedad se acerque un poco al mundo de los científicos y más concretamente al tema de la radiactividad.
DESCUBRIMIENTO DE LA RADIACTIVIDAD
Los antiguos griegos propusieron que la materia no podía ser dividida indefinidamente, de tal forma que supusieron que ésta debía estar compuesta por unidades indivisibles a las que llamaron átomos (de palabras griegas que literalmente significan: sin división). Los griegos supusieron que las diversas formas que los átomos tenían -los cuales eran sólidos- determinaban las características de las diferentes sustancias.
Después vino la idea de los elementos, la cual suponía que diferentes elementos estaban constituidos por diferentes clases de átomos. John Dalton (1766-1844) mostró que cada elemento estaba formado de átomos que diferían en masa de los átomos de otros elementos. Por ejemplo, el carbón tiene una masa relativa de 12, el oxigeno de 16, siendo la unidad el átomo de hidrógeno, el cual es el más ligero de todos los átomos.
Los químicos habían estudiado el comportamiento de los gases y habían notado que si doblaban el volumen del gas, la presión disminuía a la mitad y si dividían a la mitad el volumen, su temperatura se duplicaba. Durante mediados del siglo XIX, James Clerk Maxwell (1831-1879) explicó la ley de los gases aplicando estadística al movimiento azaroso de los átomos. Mostró que cuando se calienta un gas sus moléculas incrementan sus velocidades, lo que hace que reboten contra las paredes de contenedores con más fuerza y de esta forma incrementando la presión. Para mantener la misma presión el volumen debe de incrementarse. Para estas fechas, los átomos eran dados por hecho y tratados como simples esferas. En este punto, tal concepto de los átomos -como simples esferas- se vino abajo por descubrimientos hechos hacia el final de el siglo XIX.
Tambien se creía a finales del siglo XIX, que los componentes básicos de la materia conocida eran estables, siempre iguales, inmutables. Se pensaba que cuando un material no recibe influencia externa alguna (no se calienta, no se parte, no se tiñe, etc.), permanecerá igual a través del tiempo, sus átomos no cambiarán: es decir desde un lenguaje más científico se creía que las moléculas podían sufrir transformaciones, recombinándose para formar otras, pero los átomos se mantenían
siempre inalterados.
Pero, en 1896 Becquerel informó a la comunidad científica un fenómeno que no encajaba con esta
idea de la inmutabilidad de los materiales...
1 . HENRI BECQUEREL

Poco después de que se descubriera los rayos X, en 1895;
Antoine Henri Becquerel (1852-1908) mostró un fenómeno que no era explicable de acuerdo con el modelo inmutable que se tenía de los átomos. Había observado repetidas veces que unas placas fotográficas envueltas en papel negro junto a un cierto mineral (que luego sería denominado pecblenda), se habían ennegrecido (se habian velado). Esto sucedía de un día para otro, es decir en un tiempo relativamente cortos, lo que hacía suponer que el cambio se debía a un agente externo. No podía entrar luz a las placas, y éstas
no habían sido calentadas. Tampoco podían haber sido afectadas por algun agente químico. Al revelar la placa apareció que
algún rayo emitido por el mineral debía haber penetrado a través del papel.
Pero, ¿cómo había sucedido esto? El peso de la evidencia, tras mucho repetir la operación, llevó a la conclusión que existía "algo" producido o emitido por la pecblenda, que atravesaba la gruesa protección de las placas fotográficas de la época y las impresionaba igual que cuando se sacaba una fotografía exponiéndolas a la luz visible común. De este modo Becquerel descubrió la radiactividad. Posteriormente, mostraría que los rayos provenientes del uranio podían ionizar el aire y también eran capaces de penetrar a través de láminas metálicas
delgadas.
2 . MADAM CURIE

En 1898, Marie Sklodowska Curie (1867-1934), con su esposo
Pierre Curie (1859-1906), dirigió sus investigaciones a la radiactividad. En poco tiempo el matrimonio Curie descubrieron dos elementos nuevos, el polonio y el radio, ambos radiactivos. Para confirmar su trabajo sobre el radio, procesaron una
tonelada de residuos de pecblenda, para obtener 0.1 g de cloruro de radio puro, que usaron para efectuar
más estudios sobre las propiedades del radio y determinar su masa atómica.
Marie Curie, dos años después de el descubrimiento de Becquerel, en 1898, le dio a este fenómeno el nombre
de radiactividad.
3 . ERNEST RUTHERFORD
 Ernest Rutherford, en 1899, comenzó a investigar la naturaleza de los rayos emitidos por el uranio. Encontró dos tipos de rayos, a los que llamó rayos alfa y beta.
Pronto se dio cuenta que el Uranio, al emitir estos rayos, se transformaba en otro elemento.
A la altura de 1912 se conocían ya más de 30 isótopos radiactivos y hoy se conocen mucho más. Paul Villard
descubrió en 1900, los rayos gamma, un tercer tipo de rayos que emiten los materiales radiactivos y que es semejante a los rayos X.
De acuerdo con la descripción del átomo nuclear, Rutherford se atribuyó el fenómeno de la radiactividad a reacciones que
se efectúan en los núcleos de los átomos.
Ernest Rutherford, en 1899, comenzó a investigar la naturaleza de los rayos emitidos por el uranio. Encontró dos tipos de rayos, a los que llamó rayos alfa y beta.
Pronto se dio cuenta que el Uranio, al emitir estos rayos, se transformaba en otro elemento.
A la altura de 1912 se conocían ya más de 30 isótopos radiactivos y hoy se conocen mucho más. Paul Villard
descubrió en 1900, los rayos gamma, un tercer tipo de rayos que emiten los materiales radiactivos y que es semejante a los rayos X.
De acuerdo con la descripción del átomo nuclear, Rutherford se atribuyó el fenómeno de la radiactividad a reacciones que
se efectúan en los núcleos de los átomos.
ORIGEN DE LA RADIACTIVIDAD
-
ESTRUCTURA DE LA MATERIA
-
PROPIEDADES QUÍMICAS DE LOS ELEMENTOS
-
ISÓTOPOS
-
DESINTEGRACIONES NUCLEARES
-
TIPOS DE RADIACIONES
-
VIDAS MEDIAS DE LOS ELEMENTOS RADIACTIVOS
Los átomos constituyen la porción más pequeña de un elemento que
podamos considerar como tal. Los átomos son demasiado pequeños como para verlos aún con la ayuda de un microscopio convencional. Dentro de este punto · (de casi 1 milímetro cuadrado) cabrían aproximadamente cien
billones de átomos, es decir 20.000 veces la cantidad de habitantes que tiene nuestro planeta. El tamaño de un átomo se mide por tanto, usando una escala mucho mas pequeña que la que habitualmente usamos para medir distancias: Los Ångström

Los átomos están compuestos, en una descripción simplificada, por un núcleo central muy pequeño y por partículas llamadas electrones que están dando vueltas alrededor del núcleo, a gran velocidad. Los núcleos de los átomos están formados por partículas llamadas nucleones, entre las que se encuentran los protones
(partículas eléctricamente positivas) y los neutrones (que como su nombre lo indica son eléctricamente neutras). El número de protones es el número atómico, que se representa generalmente con la letra Z. Este número es fundamental ya que define las propiedades químicas de cada átomo, y es igual a la cantidad de electrones que tiene ese átomo cuando es eléctricamente neutro. Por ejemplo, Z=26 es el hierro (Fe), Z=27 es el cobalto (Co), Z=28 es el níquel (Ni), Z=29 es el cobre (Cu), Z=30 es el zinc (Zn).
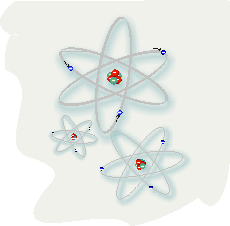
El tamaño del núcleo es muchísimo menor que el del átomo (aproximadamente 10.000 veces menor), es decir unos 0,000.000.000.001 cm, lo que equivale a 10-12 cm. ¿Qué significa este tamaño? Para hacernos una idea, pensemos que si el núcleo tuviera el tamaño de un grano de arena fina (de 0,1 mm por ejemplo) los electrones deberían girar a 1 metro de distancia. Si el átomo tuviera el tamaño de un campo de fútbol, el núcleo tan sólo tendría el tamaño de un botón.
 El volumen del espacio ocupado por el núcleo es tan pequeño que se necesitarían alrededor de 1.000.000.000.000 (un billón) de núcleos para cubrir el volumen ocupado por el átomo. Pensemos para ello en una pecera de
1 metro de diámetro e imaginemos los granos de arena fina que puede contener. Si el volumen del
núcleo fuera 1 litro, el átomo tendría el volumen de una pileta denatación de 10 km de largo por 10 km
de ancho por 10 metros de profundidad.
El volumen del espacio ocupado por el núcleo es tan pequeño que se necesitarían alrededor de 1.000.000.000.000 (un billón) de núcleos para cubrir el volumen ocupado por el átomo. Pensemos para ello en una pecera de
1 metro de diámetro e imaginemos los granos de arena fina que puede contener. Si el volumen del
núcleo fuera 1 litro, el átomo tendría el volumen de una pileta denatación de 10 km de largo por 10 km
de ancho por 10 metros de profundidad.
Volver a Origen de las Desintegraciones
Durante el siglo XIX los químicos habían identificado y clasificado a la mayoría de los elementos naturales que hoy conocemos en base a sus reacciones y afinidades químicas. Dimitri Mendeleev fue ordenándolos por familias en una tabla (hoy conocida como tabla periódica o tabla de Mendeleev) teniendo en cuenta las características
similares.
Posteriormente Henry Moseley reordenó los elementos en base
a sus números atómicos (cantidad de protones en el núcleo) configurándola
bajo el aspecto que tiene actualmente. Además de clasificar a los 83
elementos naturales, se incluyen todos los elementos artificiales creados
por el hombre.
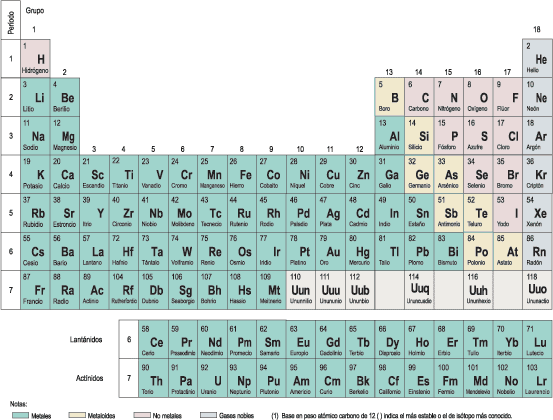
Todos los elementos que existen tienen diferentes propiedades, pero se
pueden agrupar de acuerdo a sus afinidades químicas. Por ejemplo los gases
nobles (helio, neón, argón, criptón, xenón y radón) en general es muy
difícil que se combinen químicamente con otros elementos. Los llamados
metales alcalinos (litio, sodio, potasio, rubidio, cesio y francio)
reaccionan espontáneamente con el oxígeno, mientras que los llamados
halógenos (flúor, cloro, bromo, iodo y astato) lo hacen con el hidrógeno.
Y así podemos seguir con todos los diferentes grupos (o familias) que
integran la tabla periódica y que comparten propiedades similares. En la tabla periódica se pueden encontrar todos los
elementos identificados hasta el presente, que entre naturales y artificiales
superan ya los 110.
La mayoría de las propiedades físicas y químicas de un elemento están determinadas por el número de electrones y sus posiciones en los átomos. En los atomos neutros, el numero de electrones es igual al numero de protones ( Este numero se conoce como número atómico (Z)) Esto hace que las principales propiedades de cada atomo vengan dadas por este numero.
Volver a Origen de la Radiactividad
Como hemos dicho, los núcleos de los átomos están formados por partículas llamadas
nucleones que son de dos tipos: los protones (partículas eléctricamente positivas) y los neutrones (que como su nombre lo indica son eléctricamente neutras). Todos los átomos de un mismo elemento tienen la misma cantidad de protones y por tanto, la misma cantidad de electrones. Esto hace que tengan similares propiedades químicas. (El comportamiento químico de un átomo está asociado al número atómico.)
Pero, existen átomos que teniendo el mismo número de protones, tienen diferente cantidad de neutrones. Se denominan los isótopos de ese elemento. Así como el número atómico caracteriza a elementos diferentes, el número másico, que es la
suma de protones y neutrones que hay en el núcleo, caracteriza isótopos diferentes.
El núcleo del átomo de oxígeno tiene 8 protones (esto es imprescindible para que sea oxígeno), pero se encuentran en la naturaleza
en forma estable nucleos con 8 neutrones (99,756 %), con 9 neutrones (0,039 %) y con 10 neutrones (0,205 %).
Resumiendo: Los isótopos de un mismo elemento son las distintas variedades existentes de núcleos que tienen la misma cantidad de protones, pero distinto número de neutrones. Para definir completamente de qué núcleo se trata, deberemos entonces decir cuántos protones y cuántos neutrones tiene. Para un mismo elemento de la tabla periódica, existe una gran cantidad de diferentes isótopos. Esto hace que el número de núcleos posibles sea enorme. Todos los isótopos de un mismo elemento se deben colocar en el mismo lugar de la tabla periódica (De ahí el nombre de isótopos). Hay elementos que tienen hasta 20 ó 30 isótopos diferentes.
El análogo a la tabla periódica, pero considerando todos los posibles isótopos de cada elemento se conoce como la Carta Nuclear:

A cada uno de estos núcleos diferentes los llamamos "nucleidos". La cantidad total de nucleidos identificados hasta el presente es muy grande,
próxima a los 2000.
Se diseñó una carta o tabla de nucleidos para sistematizar la información sobre ellos. Se ordenan en casilleros: en distintas filas de acuerdo a la cantidad de protones y en distintas columnas de acuerdo a la cantidad de neutrones.
Así encontraremos que en la fila 8 están los nucleidos que tienen 8 protones, es decir, encontraremos a todos los isótopos del oxígeno. De la misma forma, en la fila 92 estarán todos los isótopos del uranio.
Dentro de cada casillero de la tabla de nucleidos se incluye normalmente información sobre el nucleido en particular, de utilidad para los científicos nucleares. Una información relevante es si el nucleido en cuestión es estable o inestable. Para ello,además de datos numéricos, es común dar a cada casillero un color particular. En nuestra carta de nucleidos hemos pintado de negro los casilleros de los nucleidos estables, mientras que los inestables tienen otro color.
Entre los nucleidos de la carta solo algunos (pocos) son llamados estables, es decir que no se transmutan por sí solos en otros isótopos y por lo tanto no se alteran con el paso del tiempo. Los otros, inestables, emiten radiaciones: son los isótopos radiactivos o radioisótopos.
Lo primero que nos asombra es ver que los casilleros negros son muy pocos, hay muchísimos más nucleidos inestables que estables. Sin embargo es mucho más fácil encontrar nucleidos estables que con nucleidos inestables, ya que aquellos tienen una vida "eterna" mientras que los segundos se van transformando en otros nucleidos.
En la carta de los nucleidos, la curva que forman los casilleros negros es llamada "línea de estabilidad", como si se pudiera trazar. A la derecha de la línea de estabilidad se ubican los isótopos radiactivosque tienen más neutrones que los isótopos estables (color celeste). A la izquierda se ubican los isótopos radiactivos que tienen menos neutrones que los estables (color rosa).
Los isótopos que están fuera de la línea de estabilidad, emiten radiaciones, dando como resultado otro nucleido más cercano a la línea de estabilidad. En la zona celeste se emiten partículas negativas, normalmente electrones, que constituyen la radiación (beta -) . Se dice que el nucleido ha tenido entonces un "decaimiento beta". La pérdida de una carga negativa en el núcleo puede interpretarse como que un neutrón se transformó en un protón, por lo que el nuevo nucleido está una fila más arriba y una columna más a la izquierda que el nucleido original, acercándose a los casilleros negros.
En la zona rosa en cambio, las partículas emitidas son positivas (positrones). Aquí sucede a la inversa: en el "decaimiento beta más", todo pasa como si un protón perdiera su carga y se transformara en un neutrón, por lo que el nucleido hijo se encuentra una fila más abajo y una columna más a la derecha que el original, también acercándose a los casilleros negros.
En líneas generales se comprueba que los nucleidos que están más alejados de la línea de estabilidad son los más inestables. Esto significa que muy rápidamente desde que son creados (ya sea directamente o bien como consecuencia de algún decaimiento) emiten alguna radiación, mientras que los cercanos a los casilleros negros tardan más en hacerlo.
Además de la emisión beta, en el caso de los nucleidos muy pesados es común la emisión de partículas alfa. Casi siempre el decaimiento de un nucleido mediante la emisión de una partícula cargada (alfa, beta), es acompañada además por la emisión de radiación gamma.
Volver a Origen de la Radiactividad
Los núcleos, a pesar de la repulsión eléctrica entre los protones (ya que poseen la misma carga) existe una fuerza (interacción fuerte o fuerza nuclear) que dentro del núcleo atrae a los nucleones entre sí. Esta interacción de corto alcance (no es apreciable fuera del núcleo), permite a los núcleos se pueden mantener unidos. Claramente, los neutrones ayudan a esta cohesión. Sin embargo hay núcleos que no logran mantener indefinidamente su cohesión y producen la emisión de partículas y radiaciones. A estos átomos los llamamos radiactivos
Se observa experimentalmente que en general los núcleos son radiactivos cuando:
- Hay más protones que neutrones
- Son demasiado pesados
- Tienen un número impar de protones y de neutrones
Los núcleos inestables o radiactivos se van transformando en núcleos de otras sustancias por
emisión de partículas o por su división en núcleos más ligeros. Es decir, que las sustancias radiactivas se van "gastando" solas. Lo que queda en su lugar es otra sustancia que puede ser, así mismo, radiactiva o estable. A medida que una sustancia radiactiva se va "gastando", emite menos radiación porque va quedando menos cantidad de material radiactivo. Es decir, los isotopos radiactivos van sufriendo desintegraciones hasta alcanzar algun estado estable
Los principales tipos de desintegraciones nucleares son:
Volver a Origen de la Radiactividad
Son muchas las radiaciones que existen: rayos ultravioleta, infrarroja, luz visible,ondas de radio, microondas, rayos alfa, beta y gamma ... La descripción y comprensión de las mismas no fue la obra de una sola persona, sino el producto del aporte de muchos científicos durante fines del siglo XIX y todo el siglo XX, tarea que aún continúa. Se destacan en los primeros tiempos Rutherford y colaboradores, que investigaron en detalle la naturaleza de las radiaciones emitidas logrando identificar tres:
- ALFA - Resultaron ser núcleos de helio (o sea átomos del gas noble helio
despojados de sus únicos dos electrones).
- BETA - Resultaron ser electrones(Beta menos)
o positrones (Beta más) muy rápidos,
- GAMMA - Consisten en Radiación Electromagnética (similar a otras radiaciones que nos son más
familiares como la luz visible o los rayos X), pero con la diferencia de ser mucho más energéticos.
Se distinguió entre estas partículas emitidas por su distinto comportamiento frente a un campo magnético. Ésto es debido a que:
CARGA ELECTRICA DE LAS RADIACIONES IONIZANTES
| PARTÍCULAS ALFA (NÚCLEOS DE He) |
+2 |
| PARTÍCULAS BETA MENOS (ELECTRONES) |
-1 |
| PARTÍCULAS BETA MAS (POSITRONES) |
+1 |
| RAYOS GAMMA |
0 |
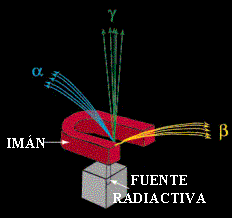
Todas las radiaciones consisten en general, en la emisión o intercambio de partículas. Por ejemplo, la radiación beta consiste en la emisión de electrones o positrones muy rápidos, en la radiación gamma se emiten fotones...
[NOTA: Según la descripción que hace la física cuántica de las ondas electromagnética (luz visible, rayos X...), estas ondas, presentan un doble comportamiento "Dualidad Onda-Corpúsculo". Presentan propiedades de ondas y propiedades de partículas llamadas fotones. Esto hace que se puede ver la emisión de luz como la emisión de una serie de fotones.]
Desde el punto de vista del efecto que tienen sobre la materia (por ejemplo, sobre el cuerpo humano) se han clasificado en
ionizantes y no ionizantes. Entre las primeras están los rayos X, rayos alfa, beta y gama. Estas radiaciones son capaces de ionizar la materia por donde pasan, esto significa que provocan desprendimiento de electrones de los átomos, y si éstos están formando moléculas en células, afectará el
comportamiento del organismo. Esto se debe a la gran cantidad de energía que poseen. Las radiaciones no ionizantes son menos energéticas y no tienen este efecto sobre la materia. Podrán calentarla (radiación infrarroja), o atravesarla fácilmente (ondas de radio), pero su impacto biológico es en general despreciable.
PENETRACION DE LAS RADIACIONES IONIZANTES EN LA MATERIA
Las Partículas Alfa de los materiales radiactivos son
detenidas fácilmente por un pedazo de cartón.
Las Partículas Beta
penetran el cartón pero son detenidas por una lámina de aluminio.
Los
Rayos Gamma logran atravesar la lamina de aluminio,
pero acaban siendo absorbidos por un bloque grueso de plomo.
Los Neutrones
producidos por ejemplo en reactores de fisión, logran atravesar incluso el plomo, pero no un bloque grueso de hormigon. |
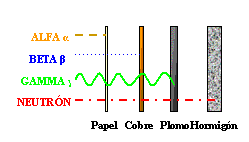 |
Volver a Origen de la Radiactividad
Cada núcleo radiactivo se desintegra según la intensidad o rapidez específica constante, siendo distinta para cada especie. Así, por ejemplo, mientras que unos isótopos radiactivos se desintegran en menos de un segundo, otros tienen una vida mucho más larga, de hasta miles de años.
Para caracterizar estos tiempos, se usa el concepto de vida media. La vida media (t1/2) es el tiempo
necesario para que se desintegre la mitad de una determinada cantidad de un núcleo radiactivo. Como hemos dicho, las semividas de los elementos alcanzan, desde una fracción de segundo, hasta miles de millones de años. Un núcleo estable puede considerarse, por tanto, como un núcleo con una vida media infinita. Por ejemplo, el
23892 U tiene una semivida de 4.5 x 109 años,
el 22688Ra tiene una semivida de 1620 años y el
156C tiene una semivida de 2.4s. Como ejemplo, si hoy se
tuviera 1.0g de 22688Ra, al cabo de 1620 años se tendrían
0.5 g de 22688Ra; al final de otro período de 1620 años,
quedarían 0.25 g y así sucesivamente.
Las vidas medias de los radioisótopos del mismo elemento son
distintas. En la tabla siguiente, aparecen las de algunos isótopos del
Radio, Carbono y Uranio.
| Vida Media de isótopos del Radio, Carbono y
Uranio |
| Isótopo |
Semivida |
Isótopo |
Semivida |
| Ra 223 |
11.7 días |
C 14 |
5668 años |
| Ra 224 |
3.64 días |
C 15 |
24 segundos |
| Ra 225 |
14.8 días |
U 235 |
7.1 x 108
años |
| Ra 226 |
1620 años |
U 238 |
4.5 x 109
años |
| Ra 228 |
6.7 años |
|
|
Volver a Origen de la Radiactividad
RADIACTIVIDAD NATURAL
La radiactividad no es nada nuevo. Existe desde que se formó
la Tierra hace 4500 millones de años. No se puede percibir por el olfato, el
gusto, el tacto, el oído ni la vista. Sólo en los últimos años se ha aprendido a
detectarla, medirla y controlarla.
Al contrario de la creencia popular, la radiación no sólo se
produce en las centrales nucleares o en las bombas atómicas (que en realidad deberían llamarse bombas nucleares).
En efecto, un 87% de la dosis de radiación que recibimos proviene de fuentes naturales. La radiactividad
está en todas partes: en las casas, en el aire que respiramos, en los
alimentos que tomamos; incluso nuestro propio cuerpo es radiactivo. La Tierra es
radiactiva por naturaleza y expone a los habitantes a la radiación proveniente
de las rocas superficiales y el suelo.
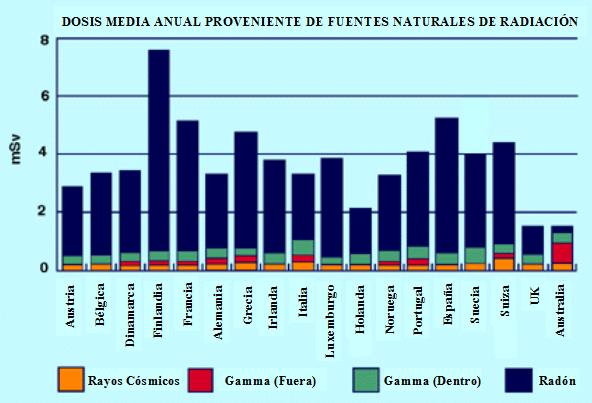
La radiación natural en la tierra y las rocas, da una dosis
promedio de 60 mrem (rem es la unidad para medir la dosis de radiactividad) por año.
Estos materiales forman parte de las viviendas, dado que sese utilizan estas rocas en los materiales de construcción,
añadiendo cantidades apreciables de radiación. Por ejemplo, el habitar en una
casa de ladrillo o piedra, el hombre se expone a 7 mrem más por año que si se
habita en una casa de madera. Todos los edificios de granito emiten radiaciones y el vivir sobre granito
añade cantidades apreciables de radiación. El gas
radón, que surge del radio natural contenido en los materiales de construcción,
también está presente en las casas y oficinas y emite más radiación. Incluso el
dormir junto a otra persona puede aumentar nuestra dosis anual de radiación, ya
que cada cuerpo contiene potasio radiactivo, que existe normalmente junto con el
potasio normal que es esencial a la vida, dando una dosis de radiación
interna.
Existen unas recomendaciones sobre la cantidad de radiación a la que nos vemos expuestos, marcando
el límite de qué cantidad se considera ya peligrosa: Limite permitido de dosis de radiación recibida
La radiactividad natural también se introduce en el cuerpo y
estas radiaciones internas llegan a la mayoría de los tejidos corporales, en una
cantidad aproximada de 18 mrem por año. Tanto el alimento como el agua y el
aire, contienen niveles bajos de radiactividad natural y esto ha sido así desde
el comienzo del mundo.
Las fuentes naturales de radiación son típicas de la manera
actual de vivir. El arar la tierra libera gas radón a la atmósfera. Los
materiales radiactivos naturales se introducen en la cadena alimentaria, el aire
que se respira, y el agua que bebemos y los materiales de construcción: el
concreto, la piedra y el ladrillo emiten radiación natural
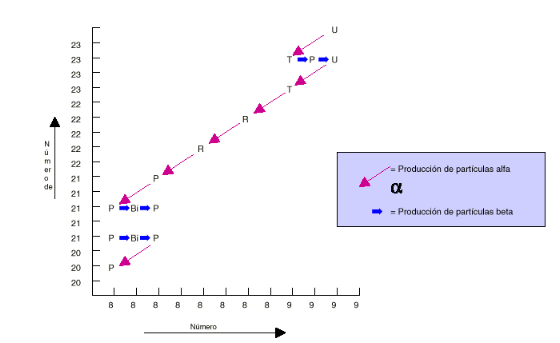
Gráfico: Serie de desintegración de
23892U a 20682Pb, las flechas
indican las transformaciones que se inician en el uranio y terminan en el plomo
las flechas horizontales indican emisión de partículas ß y las diagonales
partículas alfa.
También cuando se viaja en avión, uno se expone a recibir una radiación
mayor, ya que hay menos protección contra los rayos cósmicos. Un pasajero que
viaje en avión a una altitud normal recibe en una hora, una dosis de radiación cuatro veces mayor, que la que recibe de toda la industria nuclear en un
año.
En promedio, la industria nuclear representa menos del 0,1%
de la radiación total que el hombre recibe.
APLICACIONES Y PELIGROS
-
EVOLUCIÓN
-
DATACIÓN
-
APLICACIONES MÉDICAS
-
APLICACIONES EN AGRICULTURA
-
APLICACIONES INDUSTRIALES Y CIENTIFICAS
-
FUENTE DE ENERGIA
-
PELIGROS
La evolución de vida en la tierra según las teorías más aceptadas es fruto de las mutaciones genéticas. La presencia de una cantidad relativamente importante de Uranio en nuestro planeta convierte a la superficie terrestre en una zona con un importante contenido de radiación natural. La vida no solo ha sido capaz de desarrollarse a pesar de estar sometida a esta radiacion, sino que a base de mutaciones aleatorias de los genes debidas a estas radiaciones ionizantes ha ido evolucionando guiada por la selección natural (supervivencia de las mutaciones beneficiosas). En un planeta con una menor cantidad de radiactividad natural, la evolución de la vida hubiese sido mucho mas lenta o incluso inalcanzable. Por tanto, la humanidad, como cabeza de la cadena evolutiva, debe gran parte de su desarrollo a la radiactividad.
Volver a Aplicaciones y Peligros
El carbono 14 se produce de manera contínua en la
atmósfera, cuando neutrones de alta energía del espacio, chocan contra el
nitrógeno 14, como se ilustra en la siguiente reacción.
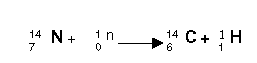
Al igual que el carbono 14, se produce contínuamente por
este proceso, se descompone en forma continua al emitir partículas beta con el
transcurso de los años, estos dos procesos opuestos, han alcanzado casi
equilibrio, por lo que la cantidad de 146C presente en la
atmósfera, permanece aproximadamente constante.
El carbono 14 artificial, que está actualmente en
circulación por la Tierra, alcanza aproximadamente una tonelada y representa
aproximadamente el 1% de la abundancia total natural. Durante los últimos siete
años, el hombre lo ha producido a un ritmo considerablemente mayor que el
resultante del proceso natural, mediante el cual se forma por la acción de los
neutrones de los rayos cósmicos. La mayoría está todavía en la atmósfera
combinado en dióxido de carbono. En los organismos vivientes se ha elevado el
contenido de carbono 14, hasta el 10% por encima de lo normal, esta situación
puede confundir a los futuros arqueólogos.
Volver a Aplicaciones y Peligros
Dentro del uso de la radiactividad en las actividades humanas, la más conocida es la de sus aplicaciones médica. El uso de la radiación en el diagnóstico y el tratamiento de enfermedades se ha convertido en una herramienta básica en medicina. Con ella se ha podido realizar exploraciones del cerebro y los huesos, tratar el cáncer y usar elementos
radiactivos para dar seguimiento a hormonas y otros compuestos químicos de los organismos.
Tabla 3
| Algunos isótopos radiactivos, sus vidas medias y
sus aplicaciones médicas como marcadores en el cuerpo
humano. |
| Núcleo |
Vida
media |
Área del cuerpo que se
estudia |
| 131 I |
8.1 días |
Tiroides |
| 59 Fe
| 45.1 días
| Glóbulos rojos
|
| 99 Mo |
67 horas |
Metabolismo |
| 32 P |
14.3 días |
Ojos, hígado, tumores |
| 51 Cr |
27.8 días |
Glóbulos rojos |
| 87 Sr |
2.8 horas |
Huesos |
| 99 To |
6.0 horas |
Corazón, huesos, hígado,
pulmones |
| 133 Xe |
5.3 días |
Pulmones |
| 24 Na |
14.8 horas |
Sistema circulatorio |
Ejemplos de Aplicaciones Médicas:
Se emplean los trazadores radiactivos normalmente en el
diagnóstico médico. Al respecto de cómo se debe detectar la radiactividad fuera
del cuerpo, generalmente se escogen isótopos radiactivos (radionúclidos)
emisores de rayos gama. También, el trazador debe ser efectivo a bajas
concentraciones y debe tener una semivida corta para reducir la posibilidad de
daños al paciente. Se emplea el yodo radiactivo (I 131) para determinar la
función tiroidea, que es donde el organismo concentra al yodo. En este proceso,
se ingiere una pequeña cantidad de yoduro radiactivo de sodio o de potasio. Se
enfoca un detector a la glándula tiroides y se mide la cantidad de yodo en la
glándula pudiendo luego comparar con el de una tiroides normal para
detectar cualquier diferencia.
También Se puede emplear el yodo 131 para el tratamiento del
hipertiroidismo. ( El mal funcionamiento de
la glándula tiroides desarrolla el bocio en las personas y causa muchos
trastornos en el metabolismo). La dosis terapéutica es mayor que la que emplea en el
diagnóstico. La glándula tiroides concentra selectivamente al Y 131. La sección
de la glándula que es hiperactiva quedará expuesta a una gran dosis del isótopo
y será la que se destruya específicamente.
Los médicos pueden examinar la eficiencia cardiaca en el
bombeo y verificar la evidencia de una obstrucción en las arterias coronarias
mediante el barrido nuclear. El radionúclido Tl 201, al inyectarse en el flujo
sanguíneo, se aloja en el tejido sano del corazón. El talio 201 emite radiación
gama, que se detecta mediante un dispositivo especial llamado cámara de
centelleo. Los datos obtenidos se traducen simultáneamente en cifras mediante
una computadora. Con esta técnica se puede observar si el tejido cardiaco ha
muerto, después de un ataque al corazón y si la sangre fluye libremente a través
de los conductores coronarios.
Una de las últimas aplicaciones de la química nuclear es el
uso de la tomografía de emisión de positrones (PET) en la medida de procesos dinámicos
en el organismo, como el uso de oxígeno o el flujo sanguíneo, y en oncología Para esta
aplicación, se fabrica un compuesto que contiene un núclido emisor de
positrones, como C 11, O 15 ó N 13. Se inyecta el compuesto en el organismo y se
coloca al paciente en un instrumento que detecta las emisiones de positrones.
Una computadora produce una imagen tridimensional de la zona. Los barridos de emisión de positrones también se han empleado para localizar las zonas del cerebro relacionadas con los ataques epilépticos. El cerebro emplea la glucosa a velocidad distinta del tejido normal.
Volver a Aplicaciones y Peligros
Quizá sea una de sus aplicaciones más polémicas. Como hemos venido indicando, las radiaciones ionizantes tienen la propiedad de ionizar (arrancar electrones) de la materia que atraviesan. Esta ionización tiene efectos biológicos que cada vez van siendo mejor conocidos. El efecto más claro es el de las mutaciones genéticas que ha habido a lo largo de la evolución. Actualmente se investiga sobre cómo aprovechar estas mutaciones y el efecto de estas radiaciones para mejorar los cultivos, evitar plagas... Así, por ejemplo, cada día vamos viendo aparecer cada vez un numero mayor de productos transgénicos (manipulados genéticamente).
Existe un tenso debate sobre si se debería permitir este tipo de investigaciones y la comercialización de estos productos. Muchas organizaciones ecologistas avisan de la existencia de riesgos potenciales en el consumo de estos alimentos. El problema involucrado reside en que las mutaciones inducidas tienen un carácter básicamente aleatorio. Esto hace que en muchos casos no se pueda predecir el efecto o efectos secundarios que tienen sobre las plantas, las radiaciones a las que se les ha sometido. Los científicos argumentan en su defensa que las radiaciones forman parte natural de la evolución y que su empleo no es algo que no haya hecho ya la Naturaleza. Además, el inmenso potencial que tienen estas investigaciones a la hora de lograr una mayor productividad agrícola, abre la puerta a una futura erradicación del hambre en el mundo.
1. Inducción de Mutaciones
Los científicos usan la radiación gamma del Co 60 u otras fuentes en la investigación agrícola para desarrollar granos resistentes a las
enfermedades, o altamente productivos. Las semillas se exponen a la radiación gama para inducir mutaciones. Las plantas más saludables y vigorosas que crecen de semillas irradiadas, se seleccionan y se propagan para obtener variedad
nuevas y mejoradas para uso comercial.
2. Medida del aprovechamiento de fertilizantes
La preservación de alimentos mediante radiación es otra aplicación benéfica. El alimento se expone a radiación gamma o
un haz de partículas beta suministradas respectivamente por Co 60 o Cs 137. Se destruyen los microorganismos que pudieran causar deterioro del alimento, pero sólo se eleva ligeramente la temperatura de éste. El alimento no se vuelve
radiactivo como resultado de este proceso, pero aumenta notablemente su duración en almacén.
3. Control de plagas
Se ha usado radiactividad para controlar y en algunas zonas, eliminar al gusano barrenador. Las larvas de este insecto se introducen en las heridas del ganado. La mosca hembra, como una abeja reina, sólo se aparea una
vez. Cuando se sueltan gran número de moscas macho esterilizadas con rayos gamma en el momento oportuno y en la zona infestada con el gusano barrenador, la mayor parte de las hembras se aparean con machos estériles. Como consecuencia, las
moscas no pueden reproducirse lo suficiente para mantener su número. Esta técnica se ha usado para erradicar en algunas zonas la mosca mediterránea de las frutas.
4. Medida del aprovechamiento de fertilizantes
Para un buen cultivo se necesita un suelo con suficientes nutrientes y humedad. Las técnicas nucleares son ideales para medir la eficacia del aprovechamiento de los fertilizantes por los cultivos y para vigilar el contenido de humedad. En la agricultura moderna, el empleo de fertilizantes es esencial para aumentar al máximo los rendimientos de los cultivos; por ejemplo, es corriente alcanzar en muchos suelos un aumento del rendimiento de los cereales, de un 50 % gracias a una fertilización eficiente. Para brindar alimentos a la población mundial que crece sin cesar, se estima que el consumo de fertilizantes dentro de 20 años ha de ser cuatro o cinco veces superior al actual. Para reducir a un mínimo absoluto la necesidad de fertilizantes y de este modo rebajar los costos de producción de los agricultores y aminorar el daño al medio ambiente, se necesitan estudios que permitan conocer las virtudes relativas de los diferentes procedimientos de fertilización en los que respecta, por ejemplo, a los métodos para aplicar el fertilizante, la oportunidad de su aplicación y los tipos de fertilizantes que han de usarse.
El método utilizado para resolver estos problemas exige introducir en el suelo cantidades conocidas de fertilizantes marcados con isótopos, en diversos tiempos y diferentes lugares. Como la planta no distingue entre los elementos provenientes del fertilizante marcado y los del suelo natural, es posible medir la cantidad exacta de nutrientes de fertilizante captados por la planta. Los resultados de esta investigación se han incorporado a
las prácticas agrícolas relativas a los cereales y han permitido aumentar de manera importante la productividad de los cultivos, reducir la aplicación de fertilizantes por ende los costos y han sido favorables para el medio ambiente al reducir considerablemente los fertilizantes residuales en los suelos. Las recomendaciones basadas en los resultados de los experimentos realizados en este
campo se han aplicado en los programas de fertilizantes organizados por la FAO en muchos países y han permitido ahorros importantes; un país que utiliza estas técnicas afirma haber ahorrado, contando únicamente los cultivos de maíz, hasta 36 millones de dólares
Volver a Aplicaciones y Peligros
Probablemente sea menos conocida la función que desempeña la
radiación en la industria y la investigación. La inspección de soldaduras, la detección de grietas en metal forjado o fundido, el alumbrado de emergencia, la datación de antigüedades y la preservación de alimentos son
algunas de sus numerosas aplicaciones.
Volver a Aplicaciones y Peligros
La energía nuclear es aquella asociada a la interacción (enlace, configuración, posición) de las partículas en el núcleo atómico. Se libera como resultado de una reacción nuclear. Aquí se muestran las dos más significativas de las reacciones nucleares en lo que a producción de energía se refiere, la reacción de Fisión Nuclear (división de los núcleos atómicos pesados) y la reacción de Fusión Nuclear (unión de núcleos atómicos ligeros).
En las reacciones nucleares se libera una gran cantidad de energía, debido a que parte de la masa de las partículas involucradas en el proceso, se transforma directamente en energía. Lo anterior se puede explicar en base a la relación Masa-Energía, E = mc2 producto de la genialidad del gran físico Albert Einstein. En relación a la liberación de energía, una reacción nuclear es un millar de veces más energética que una reacción química, por ejemplo, la generada por la combustión del combustible fósil del metano.
La gran energía que se puede generar convierten a la energía nuclear en el candidato ideal como fuente de energía para la humanidad en el futuro. A pesar de los grandes avances realizados en otros campos de la energía (eólica, solar...), difícilmente podrán ser las únicas fuentes energéticas para una sociedad futura que sin duda demandará mucha más energía que en la actualidad. Esto se debe a que su eficiencia es limitada y su disponibilidad está condicionada por las condiciones climáticas.
Lo que si resulta claro es que en unas décadas el mundo deberá replantearse qué fuentes de energía usar, habida cuenta de que las fuentes de origen químico (petróleo, carbón, gas natural) no sólo están acabándose, sino que la contaminación atmosférica que están generando tendrá consecuencias graves para todo el ecosistema terrestre (Aumento de temperaturas por efecto invernadero, lluvia ácida...). Los objetivos del protocolo de Kioto firmado en Diciembre de 1997 exigen a los gobiernos mundiales que las emisiones contaminantes emitidas a la atmósfera para en el año 2010 (2008-2012) se mantengan (e incluso desciendan un 2%) los niveles que tenían en 1990. (A España se le permite aumentar en un 15% estos niveles, dado que se consideró que era un pais que aún "contaminaba poco").
Actualmente prácticamente todos los paises están muy por encima de estos objetivos, por lo que se están diseñando acciones para lograrlos.
Es una reacción nuclear que tiene lugar por la rotura de un núcleo pesado al ser bombardeado por neutrones de cierta velocidad. A raíz de esta división el núcleo se separa en dos fragmentos acompañado de una emisión de radiación, liberación de 2 ó 3 nuevos neutrones y de una gran cantidad de energía que se transforma finalmente en calor.
Los neutrones que se producen por fisión, al disminuir su energía, alcanzan las condiciones para fisionar otros núcleos pesados, generando una Reacción Nuclear en Cadena. Cabe señalar, que los núcleos atómicos utilizados son de
Uranio 235. El proceso de la fisión permite el funcionamiento de los Reactores Nucleares que actualmente operan en el mundo.
Los riesgos inherentes a que esta reacción en cadena pueda descontrolarse, quedaron en evidencia en algún desastre ocurrido en alguna central nuclear como la de Chernobyl. En la actualidad el aumento en las medidas de seguridad de las centrales nucleares, ha reducido mucho el riesgo. También hay que indicar que una bomba nuclear como las que se lanzaron contra Hyroshyma y Nagasaky en la Segunda Guerra Mundial, consisten básicamente en una reacción nuclear de fisión no controlada.
La fusión nuclear ocurre cuando dos núcleos atómicos muy ligeros se unen, formando un núcleo atómico más pesado con mayor estabilidad. Estas reacciones liberan energías tan elevadas que en la actualidad se estudian formas adecuadas para mantener la estabilidad y confinamiento de las reacciones. Esta es la Energía que emplea el Sol y en general todas las estrellas. [Las estrellas son básicamente una bola de Hidrógeno y Helio en las que se compensa su atracción gravitatoria con la Presión de radiación de las reacciones de fusión nuclear]
La energía necesaria para lograr la unión de los núcleos se puede obtener utilizando energía térmica o bien utilizando aceleradores de partículas . Ambos métodos buscan que la velocidad de las partículas aumente para que en el momento de la colisión los nucleos puedan unirse venciendo las fuerzas de repulsión electrostáticas de la "envoltura" de electrones que los recubren en el átomo.
Para obtener núcleos de átomos aislados, es decir, separados de su envoltura de electrones, se utilizan gases
sobrecalentados que constituyen un estado de la materia denominado Plasma. El plasma es el estado en el que se encuentra la materia en el Sol y las estrellas, pues se tratan de gigantescas estructuras de mezclas de gases calientes atrapadas por su propia fuerza de la gravedad
Un ejemplo de fusión nuclear se puede representar por el siguiente esquema y relación de equilibrio:
2H + 2H --> 3He + 1n+ 3,2 MeV
Otro ejemplo de reacción de fusión es aquel en que actúan como reactantes dos isótopos de hidrogéno, el deuterio y el tritio, dando como productos de la reacción helio-4, un neutrón y una gran cantidad de energía:
Las Bombas Nucleares de Hidrógeno (conocidas como Bombas H) se basan en este tipo de reacciones. Al ser
una reaccion más energética que la de fisión, su poder destructivo es muy superior.
Una central nuclear es una planta térmica en la que el calor
lo produce el reactor de fisión en vez de una cámara de combustión. Los principales componentes de un reactor nuclear son (1) una disposición de material reactivo fisionable, que constituye el núcleo del reactor, (2) un sistema de control, que regula la velocidad de fisión y por lo mismo la tasa de generación de calor y (3) un sistema de enfriamiento, que elimina el calor del
reactor y también mantiene el núcleo a la temperatura adecuada. Un cierto tipo de reactor emplea pastillas metálicas que contienen uranio enriquecido con U 235, desde un nivel normal de 0.7 %, hasta aproximadamente 3 %. Se modera, o
controla, la reacción autosostenida de fisión, mediante las barras o varillas de control de posición regulable. Estos elementos contienen sustancias que refrenan y capturan algo de los neutrones que se producen. [Esto evita que las reacciones en cadena se vuelvan descontroladas] Para enfriar se usan agua ordinaria, agua pesada, sodio fundido y otros. La energía obtenida de la reacción nuclear es en forma de calor, y se usa en la producción de vapor para impulsar las turbinas que impulsan a los generadores de electricidad.
Son muchas las ventajas que ofrece la fusión nuclear frente a la fisión (En la que se basan actualmente las centrales nucleares):
- No hay riesgo de desastres nucleares.
- Los residuos radiactivos que generan son mínimos.
- La vida media de estos residuos es tan solo de unos pocos años.
- Es capaz de generar mucha más energía.
- No necesita Uranio, dado que emplea Hidrógeno.
Pero por supuesto, existe un "pequeño" incoveniente: Debido a las enormes dificultades tecnológicas y económicas que presenta el lograr la fusión controlada, aún no se ha podido construir una planta nuclear capaz de realizar la fusión con un rendimiento energético favorable. El fúturo proyecto ITER tiene como objetivo el construir este tipo de planta y mostrar así la viabilidad de la fusión nuclear como fuente energética. Solo hace falta que los gobiernos de todos los paises involucrados en este proyecto se pongan de acuerdo sobre la sede donde construir la planta. España, una de los paises inicialmente candidatos, perdió su candidatura frente a su competidora europea Francia en Diciembre de 2003.
Volver a Aplicaciones y Peligros
La radiactividad puede ser peligrosa y sus riesgos no deben tomarse a la ligera. Puede dañar las
células del organismo y la exposición a altos niveles, puede ser nociva e incluso fatal si se trata de manera inadecuada, por eso lleva un largo proceso de investigación y descubrimientos abriéndose las puertas de la era nuclear.
Después de muchos años de investigación, desarrollo y aplicaciones industriales, hoy se puede afirmar que existen soluciones tecnológicas bastante seguras para manejar adecuadamente los desechos radiactivos. Estos no solo provienen de los reactores que generan electricidad, sino también de los hospitales, la industria, la agricultura y la investigación,
como ya se estudió en los apartados anteriores donde se conocieron las aplicaciones de la radiactividad en esos campos.
La desventaja principal de las plantas nucleares es que producen desechos altamente radiactivos, algunos de los cuales tienen semividas de miles de años. Hasta ahora, no se ha logrado un consenso sobre cómo alamcenar con seguridad de tales productos radiactivos.
Aproximadamente una vez al año, se extrae una parte del combustible nuclear colocado dentro del reactor nuclear de fisión y se sustituye por uno nuevo. El combustible gastado es muy radiactivo y debe aislarse por miles de años con mucho cuidado, de lo contrario causaría daños irreparables a las personas y al ambiente. Es extraído del reactor por manos mecánicas y colocado en piscinas con agua para enfriarlo y aislarlo por poco tiempo, mientras es llevado al depósito permanente. También se almacena en contenedores de hormigón o acero mientras se les da el lugar definitivo.
Este uranio gastado también se reutiliza en la actualidad, Francia, Reino Unido y la Federación Rusa, cuentan con plantas de reelaboración a nivel industrial y mundial para la obtención de uranio y plutonio, en el
proceso químico. Este tipo de desecho representa un 95% ya que una planta típica nuclear de generación eléctrica produce 30 toneladas anuales de uranio gastado, esta cantidad puede reducirse a 3 m3 de desecho
radiactivo.
También se cuentan, con desechos radiactivos sólidos, líquidos y gaseosos. Entre los sólidos se cuentan toallas, papel, vidrio metales y otros materiales usados en la central. Cada uno tiene su manera de ser
tratados para evitar problemas.
Los sólidos altamente radiactivos se sellan en recipientes de metal o cerámica resistentes a la corrosión, para evitar que la humedad los afecte. Actualmente algunos países que se dedican a la reelaboración del
combustible gastado lo vitrifican. Hay acuerdos que la manera idónea para aislar esos desechos es colocarlos en cavidades profundas de la tierra, con barreras tecnológicas y naturales como por ejemplo minas de sal, granito, arcilla,
basalto (roca volcánica) y otras más.
Los desechos sólidos vitrificados se sellan en recipientes
de metal o cerámica resistentes a la corrosión para evitar que la humedad los
afecte.
Dos eventos que demostraron los peligros potenciales de la energía nuclear fueron los accidentes en la isla Three Mile, en Pennsylvania, EUA (1979) y Chernobyl, URSS (1986). Ambos accidentes fueron originados por la
pérdida de refrigerante en el núcleo del reactor. Los reactores en la isla Three Mile están envueltos por cascarones de cemento y por lo tanto dejaron escapar una cantidad relativamente pequeña de material radiactivo a la atmósfera. Como en la Unión Soviética no se usan estructuras de contención para las plantas nucleares, el accidente de Chernobyl ocasionó 31 muertes y la afectó en diverso grado hasta un total de 135000 personas. La descarga de grandes cantidades de Y 131, Cs 134 y Cs 137 generaron problemas de salud a largo plazo en esa población queestuvo expuesta.
Sin embargo, aunque muchos puedan creer que una central nuclear puede
explotar como una bomba atómica, esto no es así. Las bombas atómicas y las centrales nucleares son esencialmente diferentes. Las bombas para explotar requieren la unión rápida de dos piezas de uranio-235 metálico casi puro, formando una masa compacta de geometría definida. Un reactor nuclear típico, que produzca vapor para una central eléctrica, utiliza uranio cerámico (normalmente
en forma de óxido), no metal, con un contenido de uranio-235 sólo del orden del
3 %; el resto del uranio se compone de uranio 238 que no se fisiona en el reactor.
Hay que indicar que en la actualidad, la experiencia que ha adquirido la industria nuclear
en el uso de sustancias radioactivas, ha permitido a ésta conocer plenamente los peligros que entraña. Un blindaje y una contención
apropiados evitarán la fuga de radiaciones. La clara comprensión de los principios de protección radiológica
y el conocimiento exhaustivo de las propiedades de la radiación que posee la industria nuclear le permiten diseñar, construir y explotar sus plantas manteniendo en un mínimo la exposición a las radiaciones que afecta a los trabajadores y el público, de conformidad con
las directrices internacionales. La vigilancia periódica de los trabajadores de la industria nuclear y de su
ambiente de trabajo garantiza, que no se rebasen estos niveles.
Para asegurarse que el público no sufra ningún daño, el explotador de la central está obligado a
medir la radiactividad en el ambiente y comprobar mediante medidas en el aire, agua y suelos y alimentos, que las
personas que viven alrededor de la central, pueden respirar, beber y comer los alimentos de la zona sin peligro.
Las medidas de seguridad y de precaución, como toda actividad humana, ha ido evolucionando con el tiempo, tanto es así que actualmente se exige un área sin poblar alrededor de las centrales nucleares,
aunque varía de acuerdo con cada país. A finalizar 1989, existían 426 centrales nucleares conectadas a la red eléctrica en 25 países. Actualmente la cantidad de energía eléctrica representa más del 20% de la demanda.
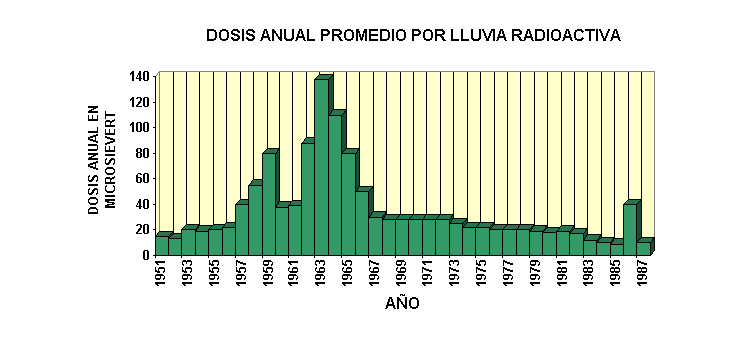
La radiactividad liberada en la atmósfera, principalmente de pruebas nucleares, se deposita poco a poco sobre la superficie de la tierra a través de la conocida como lluvia radiactiva. La dosis media
recibida por la población por esta causa ha pasado de valores altos en las décadas de los 50-70 (hasta 0,08-014 mSv.) a los valores actuales, del orden de 5 microSievert, aunque en algunos lugares alcanza los 10 mocrosievert.
Como puede observarse en la gráfica, el aumento de radiactividad de 1.986 se debe al accidente de la central de Chernobil.
La Historia de la humanidad nos muestra que prácticamente todo el desarrollo tecnológico que ha logrado el hombre, ha tenido de una u otra manera una aplicación militar. El gran poder de la energía nuclear es, por supuesto, el ejemplo más clamoroso de esto.
El gobierno estadounidense en la Segunda Guerra mundial reunió a los principales físicos nucleares de la época y les exigió que lograsen crear una bomba nuclear en lo que se conoció como Proyecto Manhattan. Fruto de un importante esfuerzo económico y de medios, pronto se consiguió el objetivos. El empleo de estas bombas sobre Japón marcó el final de la guerra. Una visión pesimista del mundo plantea que la humanidad se enfrentará a su propia extinción fruto de esta carrera militar. Esta claro que una (no deseada) Tercera Guerra Mundial en la que se usasen armas nucleares sería nefasta.
Volver a Aplicaciones y Peligros
CAMARA DE NIEBLA Y CONTADOR GEIGER

Cámara de Niebla

Contador Geiger
En nuestro stand de la V Feria puedes comprobar como funcionan estos detectores de radiación.
Si quieres obtener mas informacion sobre ellos, puedes ver la siguiente presentacion.
>
ACCESO A PRESENTACION SOBRE LA CAMARA DE NIEBLA [1.5 Mb ppt]
ACCESO A PRESENTACION SOBRE LA CAMARA DE NIEBLA [15 Mb pdf]
También puedes visitar los links de nuestra pagina sobre estos detectores
Visitar Links


 Ernest Rutherford, en 1899, comenzó a investigar la naturaleza de los rayos emitidos por el uranio. Encontró dos tipos de rayos, a los que llamó rayos alfa y beta.
Pronto se dio cuenta que el Uranio, al emitir estos rayos, se transformaba en otro elemento.
A la altura de 1912 se conocían ya más de 30 isótopos radiactivos y hoy se conocen mucho más. Paul Villard
descubrió en 1900, los rayos gamma, un tercer tipo de rayos que emiten los materiales radiactivos y que es semejante a los rayos X.
De acuerdo con la descripción del átomo nuclear, Rutherford se atribuyó el fenómeno de la radiactividad a reacciones que
se efectúan en los núcleos de los átomos.
Ernest Rutherford, en 1899, comenzó a investigar la naturaleza de los rayos emitidos por el uranio. Encontró dos tipos de rayos, a los que llamó rayos alfa y beta.
Pronto se dio cuenta que el Uranio, al emitir estos rayos, se transformaba en otro elemento.
A la altura de 1912 se conocían ya más de 30 isótopos radiactivos y hoy se conocen mucho más. Paul Villard
descubrió en 1900, los rayos gamma, un tercer tipo de rayos que emiten los materiales radiactivos y que es semejante a los rayos X.
De acuerdo con la descripción del átomo nuclear, Rutherford se atribuyó el fenómeno de la radiactividad a reacciones que
se efectúan en los núcleos de los átomos.